外泌體是什麼?|外泌體分離的方法與差異
外泌體是細胞釋放的微小囊泡,因為含有生物分子如蛋白質和DNA、RNA序列,所以能夠影響周圍細胞的功能,在細胞間通訊和疾病機制中扮演關鍵角色。透過了解外泌體分離的方法,我們能夠研究細胞間訊息傳遞的機制,從而揭示許多疾病的發生和發展過程。
什麼是胞外囊泡/外泌體?
細胞外囊泡(extracellular vesicles, EVs) 是由細胞分泌而形成,是一種無法自行複製的生物奈米球狀脂雙層囊泡結構。這些囊泡存在於多種生物體液中,如唾液、尿液、血液 、血清、腦脊液、乳汁等,也可能出現在細胞培養液中。
細胞外囊泡包含多種訊號因子及生物標記,如核酸、蛋白質、脂質,可作為細胞間信號傳遞、溝通的媒介,調控生理與病理機制。 根據尺寸及生物起源的不同,胞外囊泡可分為外泌體 (exosomes)、微囊泡 (microvesicles, MVs) 及凋亡小體 (apoptotic bodies) 三大類別。
胞外囊泡/外泌體之命名與生物起源
值得注意的是,由於各種細胞外囊泡的生物起源難以明確判別,因此國際胞外囊泡協會(International Society for Extracellular Vesicles, ISEV)於 MISEV2018指南中,建議改以下列方式命名:
不同的外泌體種類命名方式
|
命名依據 |
物理特徵 |
表面標記 |
囊泡的狀態或細胞起源 |
|
外泌體種類範例 |
•大小:small / medium / large extracellular vesicles (sEVs / mEVs / lEVs) •密度:low / middle, high EVs |
•D63+ / CD81+ EVs •Annexin A5-stained EVs |
•足細胞 Podocyte EVs •缺氧性 Hypoxic EVs •癌小體 Large oncosomes •凋亡小體 Apoptotic bodies |
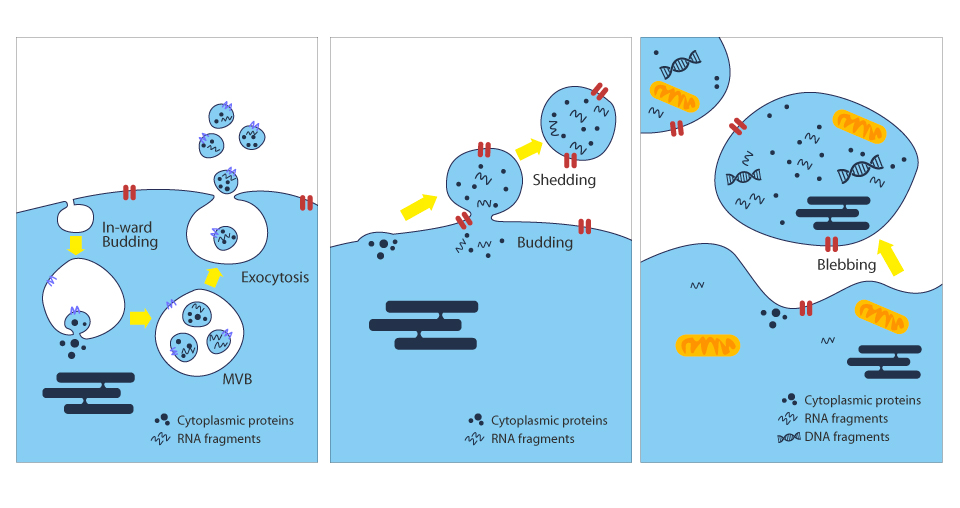
外泌體來源
相較於脂質體、奈米粒子等合成載體,外泌體來源具有內源性及異質性等特性,使得外泌體可作為優良載體,能透過多種途徑和位點將具有生物活性的物質運送至目標細胞參與調節,如組織修復、免疫調節、血管新生、細胞分化、腫瘤形成等。
因此,外泌體在疾病診斷、治療和生物研究方面,具有很大的潛力及優勢,如作為腫瘤診斷的生物標記、癌病治療的藥物載體等。
外泌體缺點
然而,外泌體也存在著一些限制,如低穩定性、低產量、低純度以及弱標靶性等因素,都可能會限制其臨床應用。
|
胞外囊泡 (Extracellular vesicles, EVs) |
外泌體 (Exosomes) |
微囊泡 (Microvesicles) |
凋亡小體 (Apoptotic bodies) |
|
尺寸 |
40~120 nm |
100~1000 nm |
1000~5000 nm |
|
生物起源/外泌體來源 |
多囊體 (Multivesicular bodies, MVB), |
細胞膜 (Plasma membrane), |
細胞膜 (Plasma membrane), |
外泌體分離的方法與差異
隨著對外泌體的研究不斷深入,其潛在應用價值也持續不斷地被發掘。外泌體的分離、純化及濃縮 (又稱富集,enrichment) 對於評估其生物學功能及其下游應用至關重要。
然而,外泌體萃取因生物樣品的成份複雜,內含許多相似的分子結構,如細胞碎片、蛋白聚集體、脂蛋白等,且外泌體的大小、組成具有異質性,使得外泌體分離更具有挑戰性。因此,「如何有效地分離與濃縮外泌體」是學術研究及臨床應用中面臨的一大考驗。
常見的外泌體分離方式比較
外泌體分離的方法很多種,依原理不同,常見方法為超速離心法、粒徑篩析層析法、超過濾法、沉澱法和免疫親和法,下表統整了各方法的差異:
|
|
超速離心法 (UC) *1 |
粒徑篩析層析法 (SEC) |
超過濾法 (UF) |
沉澱法 (Precipitation) |
免疫親和法 (IA) |
|
分離原理 |
沉降係數 (大小、密度) |
水動力半徑 (大小、分子量) |
濾膜孔徑 (大小、分子量) |
溶解度 (表面電荷) |
特異性結合 (膜蛋白標記) |
|
產率 |
低 |
中 |
高 |
高 |
低 |
|
純度 |
中 (脂蛋白) |
中高 (脂蛋白、白蛋白) |
中 (蛋白質) |
低 (蛋白質、聚合物) |
高 |
|
功能性 |
中 |
高 |
中 |
低 |
低 |
|
時間 |
> 4 hr |
0.3 hr*2 |
< 4 hr |
≈0.3~12 hr |
4~20 hr |
|
處理樣品體積 |
大 |
中 |
大*(TFF) |
大 |
小 |
|
EVs變性、失活 |
是 (高速) |
否 |
是 (剪切力) |
是 (與蛋白質或聚合物共沉澱) |
是 (沖提步驟) |
|
難易度 |
適中 |
簡單 |
簡單 |
簡單 |
適中 |
|
擴展性 |
中 |
高 |
中~高*3(TFF) |
高 |
低 |
|
其它 |
•黃金標準 •勞動密集、耗時 |
•再現性高 •EVs 功能、形態完整 |
•再現性高 •使用彈性高 •濾膜堵塞 |
•聚合物難分離 •Kit 成本高 |
•EVs 純度最佳 •特定 EV 亞群研究 •無法分離總 EVs •抗體成本高 |
*1超速離心法 (UC)又稱為差速心法 (Differential ultracentrifugation, dUC)
*2使用專業純化 kit 可於20分鐘內完成EVs純化
*3高擴展性是指 TFF 切向流過濾法 (Tangential Flow Filtration)
傳統超濾與切向流過濾的優劣勢分析
超過濾法 (UF) 是以分子大小進行分離的方法,其中又可細分為以離心驅動的超濾離心管、壓力驅動的攪拌式過濾器及切向流過濾 (tangential flow filtration, TFF) 三種類型。
超濾離心管及攪拌式過濾器的操作簡單、處理時間快,但最大的問題是濾膜易堵塞 (clogged),不僅降低分離效率且成本高;而切向流過濾技術 (TFF) 的發展則可大幅解決濾膜堵塞的問題。
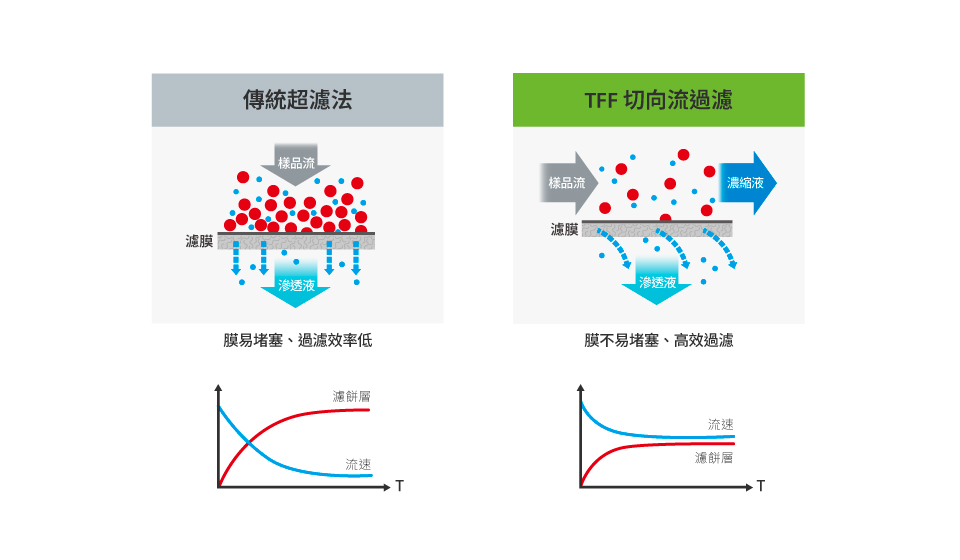
TFF切向流過濾技術用於外泌體分離
多篇文獻也指出 TFF 用於EVs 分離時,不論產量、再現性、去汙染能力都比稱為 EV 純化的黃金標準的超速離心法 (UC or dUC) 來得優秀,甚至節省了 40 % 以上的時間,更適合大規格量產的應用。
各方法的詳細比較及 TFF & UC 的 EV 分離數據,可觀看『EXOSOME 外泌體純化線上研討會直播精華』。
儘管現在已經發展出各種外泌體分離方法,但這些方法仍存在缺點,無法完全滿足分離外泌體的高純度及高產率需求。為了提高外泌體的分離效率和濃縮程度,許多研究團隊已經開始嘗試結合多種分離方法;截至目前,已有研究指出,多種分離方法比單一分離方法能更有效地提高產量和純度。例如,結合 UC 和 UF 初步萃取外泌體,再利用 IA 進一步純化目標外泌體。或者可以結合 UC 和 SEC,不僅可以處理大體積樣品,還可以有效減少污染物的干擾。在選用結合方法時,應注意各別單一方法對目標外泌體是否會造成不良影響,如外泌體變性、失活等問題。以下為 TFF 搭配各種技術進行外泌體的分離方法。
|
目標 |
EV 處理方法 |
TFF 功用 |
孔徑 |
品牌 |
樣品來源 |
|||
|
純化 |
濃縮 |
置換buffer |
||||||
|
1 |
Exosome |
TFF → SEC |
V |
V |
5 nm |
HansaBioMed, TFF-Easy |
細胞培養液 (DP-MSC) |
|
|
2 |
EVs |
TFF → SEC |
V |
V |
50 ± 10 nm |
HansaBioMed, TFF-EVs |
HPL 上清液 |
|
|
3 |
Exosome |
UC → TFF |
V |
5 nm |
HansaBioMed, TFF-Easy |
細胞培養液 (NK-92 cell) |
||
|
4 |
Plant EVs |
dUC → TFF |
V |
5 nm |
HansaBioMed, TFF-Easy |
細胞培養液 (菸草) |
||
|
5 |
Exosome |
(TFF) → Qiagen, exoEasy Maxi Kit / SEC |
V (10~20X) |
5 nm |
HansaBioMed, TFF-Easy |
細胞培養液 (cancer cells) |
||
|
6 |
Exosome |
LSC* (300g) → TFF╳ |
V |
V |
100 kDa |
Pall, Minimate |
細胞培養液 (EF-MSCs) |
|
|
7 |
EVs |
LSC* (300g) → TFF |
V |
V |
300 kDa |
Pall, Minimate |
細胞培養液 (ASC) |
|
|
8 |
EVs |
TFF |
V |
V |
V |
0.65 μm, 500 kDa |
Spectrum Labs |
細胞培養液 脂肪抽吸液 (Lipoaspirate) |
*LSC:Low speed centrifugation,低速離心法
外泌體的應用
- 疾病診斷/預後:作為生物標記用於精準醫療及預測病程,如阿茲海默症、帕金森氏症、自體免疫疾病、神經退化性疾病、癌症等
- 疾病治療 :分子藥物、治療劑、藥物載體及傳遞用於癌症治療及再生醫學等領域
- 生物研究:DNA、miRNA 等,了解各疾病的生理及病理機制
外泌體應用推薦影片 – Exosome純化線上研討會精華
參考文獻:
- A Review of Exosomal Isolation Methods: Is Size Exclusion Chromatography the Best Option, Sidhom et al., International Journal of Molecular Science, 2020
- Biological Functions Driven by mRNAs Carried by Extracellular Vesicles in Cancer, Prieto-Vila et al., Frontiers in Bioengineering and Biotechnology, 2021
- Exosome: A Review of Its Classification, Isolation Techniques, Storage, Diagnostic and Targeted Therapy Applications, Zhang et al., International Journal of Nanomedicine, 2020
- Isolation of extracellular vesicles with combined enrichment methods, Stam et al., Journal of Chromatography B, 2021
- Minimal information for studies of extracellular vesicles 2018 (MISEV2018)-a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines, Journal of Extracellular Vesicles, 2018
- Multiplexed strategies toward clinical translation of extracellular vesicles, Song et al., Theranostics, 2022
- Progress in Exosome Isolation Techniques, Li et al., Theranostics, 2017
- Review on Strategies and Technologies for Exosome Isolation and Purification, Chen et al., Frontiers in Bioengineering and Biotechnology, 2022




